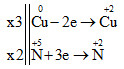Al + HNO3 → Al(NO3)3 + N2O + H2O của Trường THPT Chuyên Lê Hồng Phong hướng dẫn học sinh viết và cân bằng phản ứng oxi hóa khử. Hi vọng với hướng dẫn chi tiết cách làm đúng trên đây, các em sẽ biết cách vận dụng làm các dạng bài tập tương tự. Hãy kiểm tra.
1. Phương trình phản ứng của Al với HNO3 thu gọn
8Al + 30HNO3 → 8Al(NO3)3 + 3N2O + 15H2O
2. Chi tiết quá trình Al tác dụng với HNO3 khử
Xác định sự thay đổi số oxi
Al0 + HN+5O3 —–> Al+3(NO3)3 + N+42O + H2O.
Bạn thấy: Al + HNO3 → Al(NO3)3 + N2O + H2O
Ta có cách cho – nhận e:
8 × cho Al → Al3+ + 3e
3×| 2N+5 + 8e → 2N+4 (N2O)
⇒ Viết hệ số vào phương trình, lưu ý không tính HNO3
(vì N+5 không chỉ là chất oxi hóa mà còn là nơi chứa NO3):
8Al + HNO3 —–> 8Al(NO3)3 + 3N2O + H2O.
Lưu trữ Nitơ nguyên tố ⇒ hệ số của HNO3 là 30.
Lưu trữ nguyên tố hiđro ⇒ hệ số của H2O là 15.
⇒ 8Al + 30HNO3 → 8Al(NO3)3 + 3N2O + 15H2O
3. Phản ứng giữa Al với dung dịch HNO3 khử
Cho Al phản ứng và khử HNO3 ở nhiệt độ thường
4. Thao tác tương tự
Câu 1. Cho phản ứng: Al + HNO3 → Al(NO3)3 + N2O + H2O
Trong phương trình trên, khi hệ số của Al là 8 thì hệ số của HNO3 là
A. 24
B.30
C. 26
mất 15
Câu trả lời là không
Phản ứng thế: 8Al + 30HNO3 → 8Al(NO3)3 + 3N2O + 15H2O
Trong phương trình trên, trong khi hệ số của Al là 8 thì hệ số của HNO3 là 30.
Câu 2. Khí màu nâu trong khí quyển là
A. N2O
B. KHÔNG
C. NH3
D. NO2
Câu trả lời là không
Khí không màu nâu trong khí quyển là NO.
Câu 3. Kim loại không tan trong dung dịch HNO3 đặc nguội là
A.Mg
B. Fe
C. Ag
D. Để
Câu trả lời là không
Kim loại không tan trong HNO3 đặc nguội là Fe, Al, Cr.
Câu 4. Trong phản ứng: Al + HNO3 (khử) → Al(NO3)3 + N2O + H2O, tỉ lệ giữa số nguyên tử Al bị oxi hóa và số phân tử HNO3 bị khử (số nguyên, tối thiểu) là:
A.8 và 6.
B. 4 và 15.
C.4 và 3.
D. 8 và 30.
CÂU TRẢ LỜI ĐƠN GIẢN
Phản ứng thế: 8Al + 30HNO3 → 8Al(NO3)3 + 3N2O + 15H2O
Tỉ lệ số nguyên tử Al bị oxi hóa và số phân tử HNO3 bị khử (số nguyên, số ít) là 8 và 30.
Câu 5. Đốt cháy thanh Al trong dung dịch HNO3 khử, không có khí thoát ra. Câu phát biểu nào đúng?
A. Al không phản ứng với dd HNO3 khử
B. Al bị thụ động hóa trong dung dịch HNO3 khử
C. Al tác dụng với HNO3 tạo muối amoni
D. Cả A và B đều đúng
CÂU TRẢ LỜI CŨ
Al tan hết trong dung dịch HNO3 có tính khử nhưng không tạo oxi nên sản phẩm khử thành NH4NO3.
Phương trình hóa học:
8Al + 30HNO3 → 8Al(NO3)3 + 3NH4NO3 + 9H2O
Câu 6. Hoà tan hoàn toàn hh X gồm 8,1 gam Al và 29,25 gam Zn bằng dung dịch HNO3 12,6% (đkc) thu được V lit N2O (dktc, chỉ có oxi) và dd Y có 154,95 gam chất tan. muối. Giá trị của V là:
A. 3,36
B. 5,04
C. 4,48
D. 6,72
Đáp án A
mAl(NO3)3 = 8,1.213/27 = 63,9 gam
mZn(NO3)3 = 29,25.189/65 = 85,05 gam
my = mAl(NO3)3 + mZn(NO3)3 + mNH4NO3
=> mNH4NO3 = 6 gam => nNH4NO3 = 0,075 mol
nN2O = (0,3.3 + 0,45.2 – 0,075.8)/8 = 0,15 mol
=> V = 0,15.22,4 = 3,36 lít
Câu 7. Criolit (còn gọi là thạch băng) chứa các phân tử Na3AlF6, được cộng vào Al2O3 trong quá trình điện phân Al2O3 nóng chảy để tạo thành nhôm. Điều nào sau đây không phải là tác dụng của criolit?
A. Nó làm tăng độ dẫn của Al2O3 hòa tan
B. Hạ nhiệt độ nóng chảy của Al2O3
C.Tạo hàng rào bảo vệ Al không bị hòa tan
D. Bảo vệ điện cực khỏi bị ăn mòn
CÂU TRẢ LỜI ĐƠN GIẢN
Criolit (hay còn gọi là thạch) có công thức phân tử là Na3AlF6, được bổ sung thêm Al2O3 trong quá trình điện phân Al2O3 nóng chảy tạo ra chất thải, vai trò của Criolit là làm tăng tốc độ chảy của Al2O3 nóng chảy, làm giảm tốc độ chảy của Al2O3 nóng chảy. nhiệt độ. Được làm bằng một rào cản để bảo vệ Al nóng chảy
Câu 8. Trộn bột sắt X với bột oxit sắt (gọi là bột mối) để nung nhôm dùng để hàn đường ray xe lửa. Kim loại X là:
A. Ag
B. Fe
C. Al
D. Đến
HỒI ĐÁP
Sử dụng bột nhôm và bột oxit sắt kết hợp với nhiệt nhôm sinh ra nhiệt độ cao làm nóng dòng nước ra.
Câu 9. Cho a gam Al vào 200 ml dung dịch gồm Cu(NO3)2 0,3M và AgNO3 0,3M. Sau khi phản ứng xảy ra hoàn toàn, thu được b gam chất rắn R. Giá trị của a, b lần lượt là:
A. 2,16 và 10,86
B. 1,08 và 5,43
C. 8,10 và 5,43
D. 1,08 và 5,16
Đáp án A
Vì R phản ứng với HCl giải phóng cacbon nên còn lại Al.
Gọi x là số nguyên tử Al phản ứng với 2 muối
Al → Al3+ + 3e
x là 3x
Ag+ + 1e → Ag
0,06 → 0,06 → 0,06
Ku2+ + 2e → Ku
0,06→ 0,12→ 0,06
=> 3x = 0,18 => x = 0,06 mol
Al + 3H+ → Al3+ + 3/2H2
0,02 → 0,03
=> b = (108 + 64). 0,06 + 27.0,02 = 10,86 gam
=> a = 27.(0,06 + 0,02) = 2,16 gam
Câu 10. M là hỗn hợp hai kim loại Ca và Al. Hòa tan m gam M vào nước dư thu được 8,96 lít H2 (đktc). Cũng hòa tan m gam X trong dung dịch KOH dư thu được 12,32 lít khí H2 (dktc). Giá trị của m là:
A.12.1
B. 21,8
C. 13,7
D. 24,2
Đáp án A
M có hỗn hợp 2 kim loại Ba, Al
Thí nghiệm 1: M + H2O →
Thí nghiệm 2: M + KOH
Và nH2 TN2 > nH2 TN1 => TN1 Al còn lại
Ca + 2H2O → Ca(OH)2 + H2 (1)
Al + OH– + H2O → AlO2– + 3/2 H2 (2)
Hôm nay x = nBa
Thí nghiệm 1:
(1) nH2 = nCa(OH)2 = nCa = x mol
(2) nH2 = 3/2 . và H– = 3/2. phép chia 2x = 3x
=> Tổng nH2 TN1 = 4x = 8,96/22,4 => x = 0,1 mol
Thí nghiệm 2:
(1) nH2 = nCa = x mol
Tổng nH2 TN2 = 12,32/22,4 = 0,55 mol
=> nH2(2) = 0,45 mol
(2) nAl = 2/3. nH2 = 0,3 mol
=> mAl = 8,1 gam
=> a = mAl + mCa = 8,1 + 0,1.40 = 12,1 gam
Câu 11. Hòa tan hoàn toàn 6,21 gam Al bằng dung dịch HNO3 khử (dư), thu được dung dịch X và 0,672 lít hỗn hợp khí Y gồm hai khí là N2O và N2. Tỉ khối hơi của hỗn hợp khí Y so với khí H2 là 18. Làm bay hơi dung dịch X thu được m gam chất rắn khan. Giá trị của m là
A. 38,34 gam
B. 34,08 gam
C. 106,38 gam
D. 53,19 gam
CÂU TRẢ LỜI ĐƠN GIẢN
nAl = 0,23 mol, nY = 0,03 mol
Gọi x, y là số mol của N2, N2O
Theo đề bài ta có hệ phương trình sau
x + y = 0,03
28x + 44y = 0,03.18,2
Giải hệ phương trình (1), (2) ta có
x = 0,015, y = 0,015
Quy trình tặng điện tử
Al → Al+3 + 3e
0,23 → 0,69
2N+5 + 10e → N2+2
0,15 0,015
2N+5 + 8e → N+12O
0,12 0,015
Ta thấy 3nAl > (8nN2O + 10nN2) => có muối amoni NH4NO3
Áp dụng định luật bảo toàn e ta có:
3nAl = 8nN2O + 10nN2 + 8nNH4+
=> nNH4+ = (0,23.3 – 0,27)/8 = 0,0525 mol
=> m = mAl(NO3)3 + mNH4NO3 = 0,23.213 + 0,0525.80 = 53,19 gam
Câu 12. Cho 1,62 gam Al phản ứng với 1000 ml dung dịch X chứa Fe(NO3)2 0,1M và Cu(NO3)2 0,09M. Pứ xong thu được m gam chất rắn. Giá trị của m là:
A. 2,88.
B. 2,68.
C. 5,76.
D. 5,68.
CÂU TRẢ LỜI CŨ
nAl = 0,06 mol;
nFe(NO3)2 = 0,1 mol;
nCu(NO3)2 = 0,09 mol
Lưu ý: neAl cho max = 0,06.3 = 0,18 mol = nCu2+ để tìm e
=> Al phản ứng hết với Cu(NO3)2; còn Fe(NO3)2 chưa phản ứng
=> chất rắn có Cu
nCu = nCu(NO3)2 = 0,09 mol => m = 5,76 gam
——————————
Mời xem các bài viết liên quan khác
Học viện Anh ngữ toàn diện NYSE trình bày Al + HNO3 → Al(NO3)3 + N2O + H2O của Học viện Anh ngữ toàn diện NYSE. Thông tin trong tài liệu giúp các bạn biết cách ghi và kiểm soát phản ứng khi Al tác dụng với dung dịch HNO3 khử, từ đó phát hiện hiện tượng sau khi thực hiện.
Các em cũng có thể tham khảo thêm các bài viết tương tự khác giúp ích cho việc học tập như: Giải bài tập Hóa 12 , Giải bài tập Toán lớp 12 , Giải bài tập Vật Lý 12 ,….
Ngoài ra, trường THPT Chuyên Lê Hồng Phong đã lập nhóm chia sẻ tài liệu ôn thi THPT Quốc gia miễn phí trên Facebook: Tài liệu học tập lớp 12 Mời các em tham gia nhóm để nhận tài liệu và đề.
Tác giả: Học viện Anh ngữ toàn diện NYSE
Thể loại: Giáo dục
Bài chia sẻ: https://c3lehongphonghp.edu.vn https://c3lehongphonghp.edu.vn/al-hno3-alno33-n2o-h2o/
Bạn thấy bài viết
Al + HNO3 → Al(NO3)3 + N2O + H2O
có khắc phục đươc vấn đề bạn tìm hiểu ko?, nếu ko hãy comment góp ý thêm về
Al + HNO3 → Al(NO3)3 + N2O + H2O
bên dưới đểHọc viện Anh ngữ toàn diện NYSE có thể thay đổi & cải thiện nội dung tốt hơn cho các bạn nhé! Cám ơn bạn đã ghé thăm Website: nyse.edu.vn của Học viện Anh ngữ toàn diện NYSE
Nhớ để nguồn bài viết này:
Al + HNO3 → Al(NO3)3 + N2O + H2O
của website nyse.edu.vn
Chuyên mục: Giáo dục
[expander_maker more=”Xem thêm chi tiết về
Al + HNO3 → Al(NO3)3 + N2O + H2O
” less=”Read less”]
Tóp 10
Al + HNO3 → Al(NO3)3 + N2O + H2O
#HNO3 #AlNO33 #N2O #H2O
Video
Al + HNO3 → Al(NO3)3 + N2O + H2O
Hình Ảnh
Al + HNO3 → Al(NO3)3 + N2O + H2O
#HNO3 #AlNO33 #N2O #H2O
Tin tức
Al + HNO3 → Al(NO3)3 + N2O + H2O
#HNO3 #AlNO33 #N2O #H2O
Review
Al + HNO3 → Al(NO3)3 + N2O + H2O
#HNO3 #AlNO33 #N2O #H2O
Tham khảo
Al + HNO3 → Al(NO3)3 + N2O + H2O
#HNO3 #AlNO33 #N2O #H2O
Mới nhất
Al + HNO3 → Al(NO3)3 + N2O + H2O
#HNO3 #AlNO33 #N2O #H2O
Hướng dẫn
Al + HNO3 → Al(NO3)3 + N2O + H2O
#HNO3 #AlNO33 #N2O #H2O
Tổng Hợp
Al + HNO3 → Al(NO3)3 + N2O + H2O
Wiki về
Al + HNO3 → Al(NO3)3 + N2O + H2O
[/expander_maker]