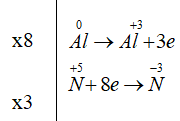Al + HNO3 → Al(NO3)3 + NO + H2O là phản ứng oxi hóa khử do trường Học viện Anh ngữ toàn diện NYSE xây dựng, phương trình này sẽ xuất hiện trong bài: Cân bằng phản ứng oxi hóa khử lớp 10, Tính chất hóa học của Al và tính chất hóa học của HNO3…. va bai tập. Hy vọng có thể giúp các bạn viết và giải phương trình một cách nhanh chóng và chính xác.
1. Phương trình phản ứng Al tác dụng với HNO3
Al + 4HNO3 → Al(NO3)3 + NO + 2H2O
2. Cho Al phản ứng với HNO3
bạn không có nó
3. Cách cho Al phản ứng với HNO3
Cho từ từ dung dịch axit HNO3 vào ống nghiệm và lá nhôm
Bạn thấy: Al + HNO3 → Al(NO3)3 + NO + H2O
4. Phản ứng của Al với HNO3
Chất rắn màu trắng nhôm (Al) tan chậm trong dung dịch, trong dung dịch xuất hiện bọt khí, để ngoài không khí chuyển sang màu tím là khí nitơ oxit (NO).
5. Hoạt động tương tự
Câu 1. Kim loại nào sau đây không phản ứng với dung dịch HNO3 đặc, dư?
A.Al
B. Zn
C.Gà trống
D. Ag
Đáp án A
Câu 2. Cho 2,7 gam Al phản ứng hết với dd HNO3 khử. Sau pứ thu được V lít NO (là chất khử duy nhất, ptc).
A. 2,24 lít
B. 3,36 lít
C. 4,48 lít
D. 8,96 lít
Đáp án A
nAl = 2,7 : 27 = 0,1 (mol)
Al → Al3+ + 3e
0,1 → 0,3 (mol)
ne cho = ne take = 0,3 (mol)
N+5 + 3e → KHÔNG
0,3 → 0,1 (mol)
=> VNO = 0,1,22,4 =2,24 (l)
Câu 3. Các mặt hàng nào sau đây có thể bằng một phương pháp?
A. K2SO4 và BaCl2
B. NaCl và AgNO3
C. HNO3 và FeO
D. NaNO3 và AgCl
CÂU TRẢ LỜI ĐƠN GIẢN
A. K2SO4 + BaCl2 → 2KCl + BaSO4
B. NaCl + AgNO3 → NaNO3 + AgCl
C. 3FeO + 5HNO3 → 3Fe(NO3)3 + NO + 5H2O
Câu 4. Sản phẩm của HNO3 là gì?
A. Tính axit mạnh, tính oxi hóa và tính khử mạnh.
B. Tính axit mạnh, tính oxi hóa mạnh và tính oxi hóa mạnh.
C. Tính oxi hóa mạnh, tính axit mạnh và tính bazơ mạnh.
D. tính oxi hóa mạnh, tính axit yếu và tính gây chết người.
Đáp án B: axit mạnh, chất oxi hóa mạnh và gây hại.
Câu 5. Nhiệt phân hoàn toàn 9,4 gam sắt nitrat thu được 4 gam chất rắn. Công thức muối đã dùng là
A. Cu(NO3)2.
B. KNO3.
C. Fe(NO3)3.
D. NaNO3.
Đáp án A
Nhìn vào câu trả lời, chúng tôi xem xét hai trường hợp sau:
TH1: MNO3 → MNO2
M + 62 → M + 46 (gam)
9,4 4 gam
=> 4(M + 62) = 9,4.(M + 46) => M = -34,14 (loại)
TH2: 2M(NO3)n → M2On
2(M + 62n) 2M + 16n
9,4 4
=> 8(M + 62n) = 9,4.(2M + 16n) => M = 32n
Ta thấy: n = 2 => M = 64 (Cu)
=> Muối đã dùng là Cu(NO3)2
Câu 6. Cho lá nhôm vào ống nghiệm chứa dung dịch Hg(NO3)2, thấy màng thủy ngân bám trên bề mặt lá nhôm. Sự kiện tiếp theo xuất hiện là:
A. Khí hiđro bay ra mạnh.
B. Khí hiđro thoát ra rồi dừng lại ngay.
C. hợp kim nhôm dễ cháy.
D. lá nhôm tan ngay trong thủy ngân và không phản ứng.
Đáp án A
phương trình phản ứng
2Al + 3Hg(NO3)2 → 2Al(NO3)3 + 3Hg
Al được tạo thành với hỗn hống Hg. Al hỗn hống phản ứng với nước
2Al + 6H2O → 2Al(OH)3 + 3H2
Câu 7. Cho 3,84 gam hợp chất X gồm Mg và Al vào 200 ml dung dịch Y gồm HCl 1M và H2SO4 0,5M. Khi khí xảy ra hoàn toàn thu được 4,256 lít khí (đktc). Trong dung dịch, axit phân li hoàn toàn thành ion. Nồng độ của Al trong X là:
A. 56,25%
B. 49,22 %
C. 50,78 %
D. 43,75 %
Đáp án A
nH+ = nHCl + 2nH2SO4 = 0,2.1 + 2.0,2.0,5 = 0,4 mol
nH2 = 4,256/22,4 = 0,19 mol
=> nH+(phản ứng) = 0,38 mol < 0,4 mol
=> axit dư, sắt ra
Đặt nMg = x mol, nAl = y mol
mX = 24x + 27y = 3,84 (1)
nH2 = x + 1,5y = 0,19 (2)
Giải hệ phương trình (1), (2) ta được
x = 0,07
y = 0,08
%mAl = (0,08,27)/3,84.100% = 56,25%
Câu 8. Cho m gam hỗn hợp X gồm Al, Cu vào dung dịch HCl đặc, dư sinh ra 1,68 lít khí (ở ptc). Nếu cho m gam hỗn hợp X ở trên cộng với các chất phụ gia sau khi lắng rồi thêm axit nitric thì sau phản ứng sinh ra 3,36 lít khí NO2 (đktc, ptc duy nhất). Giá trị của m là:
A. 12,3
B. 15,6
C. 6,15
D. 11,5
HỒI ĐÁP
Cho Al, Cu vào HCl dư, chỉ có Al phản ứng:
Al + 3HCl → AlCl3 + 3/2H2
Ta có: nAl = 2/3.nH2 = 2/3. 0,075 = 0,05 mol
Cho Al, Cu vào dd HNO3 đặc nguội, chỉ có Cu phản ứng:
Cu + 4HNO3 → Cu(NO3)2 + 2NO2 + 2H2O
Ta có: nCu = 1/2. nNO2 = 1/2. 0,15 = 0,075 mol
Vậy m gam hợp chất X chứa 0,1 mol Al và 0,15 mol Cu → m = 0,05.27 + 0,075.64 = 6,15 gam
Câu 9. Phản ứng nào sau đây không phải là phản ứng thu nhiệt?
A. Al phản ứng với Fe2O3 nung nóng.
B. Al phản ứng với CuO ngọn lửa.
C. Al phản ứng với Fe3O4 nung nóng.
D. Al phản ứng với axit H2SO4 đặc.
CÂU TRẢ LỜI ĐƠN GIẢN
Phản ứng giữa nhôm và oxit kim loại gọi là phản ứng thu nhiệt nhôm.
Câu 10. Cho m gam Al phản ứng hoàn toàn với dung dịch HNO3 loãng (dư), sinh ra 4,48 lít khí NO (dktc, đktc). Giá trị của m là
A. 4,05.
B.8,10.
C. 2,70.
D. 5,40.
CÂU TRẢ LỜI ĐƠN GIẢN
Các ứng dụng của định luật bảo toàn electron bao gồm:
nAl.3 = nNO.3 → nAl = nNO = 0,2 mol → mAl = 0,2.27 = 5,4 gam.
Câu 11. Tính chất nào sau đây không phải của nhôm?
A. Ở ô 13 mùa 2 nhóm IIIA.
B. Chuyển tiền điện tử [Ne] 3s23p1.
C. Tinh thể lập phương tâm diện.
D. Oxi bậc +3 tính chất.
Đáp án A
Chuyển đổi điện tử của nhôm [Ne] 3s23p1.
→ Al ở ô 13 (z = 13), chu kỳ 3 (3 electron lớp vỏ), nhóm IIIA (3 electron lớp ngoài cùng, nguyên tố p).
Câu 12: Làm các bài tập sau:
(a) Cho từ từ đến dư NaOH vào dung dịch Al2(SO4)3.
(b) Cho từ từ Al2(SO4)3 vào dung dịch NaOH,
(c) Cho từ từ NH3 đến dư Al2(SO4)3.
(d) Cho từ từ Al2(SO4)3 đến dư vào NH3.
(e) Thêm từ từ HCl đến dư vào dung dịch NaAlO2.
(f) Cho từ từ NaAlO2 vào HCl dư
(g) Cho từ từ Al2(SO4)3 đến dư vào NaAlO2
Trong các thí nghiệm trên, số lượng thí nghiệm dường như tăng lên theo
A.2.
B.3.
C.5.
Đ,7.
CÂU TRẢ LỜI CŨ
a) Al2(SO4)3 + 6NaOH → 2Al(OH)3 + 3Na2SO4;
Al(OH)3 + NaOH → NaAlO2 + 2H2O.
Một vụ nổ trắng xuất hiện, sau đó không khí từ từ tan chảy
b) Al2(SO4)3 + 6NaOH → 2Al(OH)3 + 3Na2SO4;
Sự xuất hiện của mưa trắng
c) 6NH3 + Al2(SO4)3 + 6H2O → 2Al(OH)3↓ + 3(NH4)2SO4
Kỳ lạ: Một cơn gió trắng xuất hiện
d)
Al2(SO4)3 + 6NH3 + 6H2O → 2Al(OH)3 + 3(NH4)2SO4
Kỳ lạ: Một cơn gió trắng xuất hiện
e) Ban đầu: NaAlO2 + HCl + H2O → Al(OH)3↓ + NaCl.
Khi đó, Al(OH)3 + 3HCl → AlCl3 + 3H2O
f) NaAlO2 + HCl + H2O → NaCl + Al(OH)3
Nhiều mưa
g) Al2(SO4)3 + 6NaAlO2 + 12H2O → 8Al(OH)3 + 3Na2SO4
Sự xuất hiện của mưa trắng
Câu 13: Cho 3,82 gam hợp kim Ba và Al vào nước dư, chỉ thu được dung dịch chứa duy nhất một muối. Thánh lễ thứ ba là:
A. 3,425 gam.
B. 1,644 gam.
C. 1,370 gam.
D. 2,740 gam.
Đáp án D: Dung dịch muối Ba(AlO2)2 nAl = 2nBa ⇒ mBa = 2,740 gam
Câu 14: Yếu tố nào sau đây có thể cùng tồn tại trong một quá trình?
A. AlCl3 và Na2CO3
B. HNO3 và NaHCO3
C. NaAlO2 và KOH
D. NaCl và AgNO3
Đáp án A
Câu 15 Dùng hóa chất nào để phân biệt Zn(NO3)2 với Al(NO3)3?
A. NaOH . giải pháp
B. Ba(OH)2 . giải pháp
C. NH3 . giải pháp
D. Bỏ nước cốt chanh
Đáp án C Khi thêm NH3 vào dung dịch 2, cả 2 dung dịch đều xuất hiện kết tủa hiđroxit nhưng Zn(OH)2 tạo thành có thể kết hợp với NH3 tạo oxi tan, còn Al(OH)3 không tan trong NH3.
……………………
Trường THPT Chuyên Lê Hồng Phong gửi đến các em phương trình hóa học Al + HNO3 → Al(NO3)3 + NO + H2O. Với phương trình hóa học này, học sinh nhận biết chất khử nào tạo ra nhiều hơn, xác định chất khử dựa vào lượng dung dịch HNO3. Tôi hy vọng bạn học tốt
Mời xem các bài viết khác:
Trên đây trường Học viện Anh ngữ toàn diện NYSE vừa gửi đến các bạn bài giải phương trình hóa học Al + HNO3 → Al(NO3)3 + NO + H2O, hi vọng qua bài viết này các bạn sẽ học tốt môn Hóa lớp 12. tham khảo Ngữ văn 12, Tiếng Anh 12, Toán ôn thi THPT Quốc gia, Đề thi THPT Quốc gia môn Lý,….
Ngoài ra, trường Học viện Anh ngữ toàn diện NYSE đã thành lập nhóm chia sẻ tài liệu học tập THPT miễn phí trên Facebook: Đồ dùng học tập Học viện Anh ngữ toàn diện NYSE. Mời các em tham gia nhóm để nhận tài liệu mới nhất.
Tôi hy vọng bạn đã học tốt.
Tác giả: Học viện Anh ngữ toàn diện NYSE
Thể loại: Giáo dục
Bài chia sẻ: https://c3lehongphonghp.edu.vn https://c3lehongphonghp.edu.vn/al-hno3-alno33-no-h2o/
Bạn thấy bài viết
Al + HNO3 → Al(NO3)3 + NO + H2O
có khắc phục đươc vấn đề bạn tìm hiểu ko?, nếu ko hãy comment góp ý thêm về
Al + HNO3 → Al(NO3)3 + NO + H2O
bên dưới đểHọc viện Anh ngữ toàn diện NYSE có thể thay đổi & cải thiện nội dung tốt hơn cho các bạn nhé! Cám ơn bạn đã ghé thăm Website: nyse.edu.vn của Học viện Anh ngữ toàn diện NYSE
Nhớ để nguồn bài viết này:
Al + HNO3 → Al(NO3)3 + NO + H2O
của website nyse.edu.vn
Chuyên mục: Giáo dục
[expander_maker more=”Xem thêm chi tiết về
Al + HNO3 → Al(NO3)3 + NO + H2O
” less=”Read less”]
Tóp 10
Al + HNO3 → Al(NO3)3 + NO + H2O
#HNO3 #AlNO33 #H2O
Video
Al + HNO3 → Al(NO3)3 + NO + H2O
Hình Ảnh
Al + HNO3 → Al(NO3)3 + NO + H2O
#HNO3 #AlNO33 #H2O
Tin tức
Al + HNO3 → Al(NO3)3 + NO + H2O
#HNO3 #AlNO33 #H2O
Review
Al + HNO3 → Al(NO3)3 + NO + H2O
#HNO3 #AlNO33 #H2O
Tham khảo
Al + HNO3 → Al(NO3)3 + NO + H2O
#HNO3 #AlNO33 #H2O
Mới nhất
Al + HNO3 → Al(NO3)3 + NO + H2O
#HNO3 #AlNO33 #H2O
Hướng dẫn
Al + HNO3 → Al(NO3)3 + NO + H2O
#HNO3 #AlNO33 #H2O
Tổng Hợp
Al + HNO3 → Al(NO3)3 + NO + H2O
Wiki về
Al + HNO3 → Al(NO3)3 + NO + H2O
[/expander_maker]