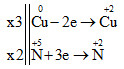CuSO4 + NaOH → Cu(OH)2 + Na2SO4 là tài liệu của trường Học viện Anh ngữ toàn diện NYSE hướng dẫn học sinh viết phương trình trao đổi giữa muối và bazơ. Cụ thể, cho CuSO4 phản ứng với NaOH, khi thực hiện có tạo kết tủa xanh lam. Hãy kiểm tra.
1. Phương trình phản ứng NaOH tác dụng với CuSO4
CuSO4 + 2NaOH → Cu(OH)2↓ + Na2SO4
2. Phản ứng giữa CuSO4 và NaOH
Nhiệt độ bình thường
3. CuSO4 + NaOH .net phương trình ion
Phương trình phân tử CuSO4 + NaOH
Bạn thấy: CuSO4 + NaOH → Cu(OH)2 + Na2SO4
CuSO4 + 2NaOH → Cu(OH)2↓ + Na2SO4
phương trình ion thu gọn
Cu2+ + 2OH– → Cu(OH)2↓
4. Phản ứng của CuSO4 với NaOH
Dung dịch sau phản ứng xuất hiện màu xanh lam là Cu(OH)2
5. Hoạt động tương tự
Câu 1. Nhỏ từ từ từng giọt dung dịch NaOH vào dung dịch CuSO4, ta thấy:
A. Có khí màu lục, khí không tan
B. Có làn gió trong lành và không khí thoát ra
C. Dông hình thành từ màu trắng xanh, sau chuyển thành mưa màu đỏ nâu.
D. Có khí màu xanh lục sinh ra, sau đó khí này bị bay hơi.
Đáp án A
2NaOH + CuSO4 → Na2SO4 + Cu(OH)2
=> Lạ: Có khí xanh, khí không tan
Câu 2. Cho 3,2 gam Cu phản ứng với 100ml dung dịch hỗn hợp (HNO3 0,8M + H2SO4 0,2M), sản phẩm khử chỉ gồm HNO3 và NO. Nồng độ của khí NO (dktc) là
A. 0,672 lít.
B. 0,336 lít.
C. 0,747 lít.
D. 1,792 lít.
Đáp án A
Câu 3. Cho các cách giải thích sau:
(Trước hết). Hòa tan Cu bằng HCl đặc nóng giải phóng H2 . khí ga
(2). Đồng dẫn nhiệt và điện tốt hơn, kém hơn Ag
(3). Đồng kim loại có thể được hòa tan trong FeCl3. giải pháp
(4). Cu tan được trong dung dịch HCl có mặt O2.
(5). Đồng thuộc nhóm kim loại nhẹ (d = 8,98 g/cm3)
(6). Cu2O không tồn tại; Cu2S
Lời giải thích đúng là:
A1.1.
B.2.
C.3.
D.4.
CÂU TRẢ LỜI CŨ
Câu 5. Dung dịch muối đồng(II) sunfat (CuSO4) có thể phản ứng với một số chất:
A. CO2, KOH, HNO3, Zn
B. H2SO4, AgNO3, Ba(OH)2, Ag
C. KOH, CaCl2, Fe, H2SO4
D. KOH, BaCl2, Zn, Al
CÂU TRẢ LỜI ĐƠN GIẢN
Dung dịch CuSO4 có thể phản ứng với: KOH, BaCl2, Zn, Al
CuSO4 + 2KOH → Cu(OH)2↓ + K2SO4
CuSO4 + BaCl2 → CuCl2 + BaSO4
CuSO4 + Zn → ZnSO4 + Cu
3CuSO4 + 2Al → Al2(SO4)3 + 3Cu
Câu 6. Hòa tan Na2CO3 vào dung dịch hỗn hợp axit HCl 0,5M và H2SO4 1,5M thu được dung dịch A và 3,92 lít khí B (dktc). Cô cạn dung dịch A thu được 24,225 gam muối khan. Tính lượng Na2CO3 đã hòa tan
A. 37,1 gam
B. 18,55 gam
C. 24,7 gam
D. 27,83 gam
Câu trả lời là không
Xét dung dịch chứa V (lít) chứa HCl 0,5M và H2SO4 1,5M.
Phương trình hóa học xảy ra:
Na2CO3 + 2HCl → 2NaCl + H2O + CO2
0,25V 0,5V → 0,5V → 0,25V (mol)
Na2CO3 + H2SO4 → Na2SO4 + H2O + CO2
1,5V 1,5V → 1,5V → 1,5V (mol)
Khi bắt đầu câu chuyện, chúng ta có:
Số mol nCO2 = 0,25V + 1,5V = 3,92 : 22,4 = 0,175 (mol) (1)
Khối lượng muối thu được: 58,5.0,5V + 142.1,5V = 24,22 (g) (2)
V = 0,1 (lít) = 100ml.
Số mol nNa2CO3 = nCO2 = 0,175 mol
Vậy lượng Na2CO3 đã hòa tan là:
mNa2CO3 = 0,175. 106 = 18,55 gam
Câu 7. Cho 9,125 gam muối hiđrocacbonat X phản ứng hoàn toàn với dung dịch H2SO4 (dư), thu được dung dịch chứa 7,5 gam muối sunfat trung hòa. Quy trình sản xuất muối bicacbonat là:
A. NaHCO3
B. Mg(HCO3)2
C. Ba(HCO3)2
D. Ca(HCO3)2
Câu trả lời là không
Cho công thức muối bicacbonat: M(HCO3)n
Phương trình: 2M(HCO3)n + nH2SO4 → M2(SO4)n + 2nCO2 + 2nH2O
Chúng tôi thấy:
2 mol M(HCO3)n → 1 mol M2(SO4)n khối lượng giảm:
2,61n – 96n = 26n (g)
Do đó x mol M(HCO3)n → M2(SO4)n thì khối lượng giảm:
9,125 – 7,5 = 1,625 (g)
=> x = (1,625,2)/26n = 0,125/n (mol) => M + 61n = (9,125/0,125/n) = 73n => M = 12n
Hai tập nghiệm tương ứng là: n = 2 và M = 24 (Mg)
Dung dịch muối bicacbonat là Mg(HCO3)2
Câu 8. Cho từ từ 30 ml dung dịch HCl 1M vào 100 ml dung dịch chứa Na2CO3 0,2M và NaOH 0,2M, số mol khí CO2 thu được sau phản ứng là:
A. 0,03
B. 0,01
C. 0,02
D. 0,015
Câu trả lời là không
Na2CO3 + HCl → NaHCO3 + NaCl
0,02 → 0,02 → 0,02
NaHCO3 + HCl → NaCl + CO2 + H2O
0,01 0,01
⇒ nCO2 = 0,01mol
…………………….
Trên đây trường Học viện Anh ngữ toàn diện NYSE vừa gửi đến các bạn phương trình hóa học CuSO4 + NaOH → Cu(OH)2 + Na2SO4, hi vọng qua bài viết này các bạn sẽ học tốt môn Hóa lớp 12 hơn. Ngữ văn 12, Tiếng Anh 12, Toán luyện thi THPT Quốc gia, Vật lý luyện thi THPT Quốc gia, v.v.
Ngoài ra, trường Học viện Anh ngữ toàn diện NYSE đã thành lập nhóm chia sẻ tài liệu học tập THPT miễn phí trên Facebook: Đồ dùng học tập Học viện Anh ngữ toàn diện NYSE. Mời các em tham gia nhóm để nhận tài liệu mới nhất.
Tôi hy vọng bạn đã học tốt.
Tác giả: Học viện Anh ngữ toàn diện NYSE
Thể loại: Giáo dục
Bài chia sẻ: https://c3lehongphonghp.edu.vn https://c3lehongphonghp.edu.vn/cuso4-naoh-cuoh2-na2so4/
Bạn thấy bài viết CuSO4 + NaOH → Cu(OH)2 + Na2SO4
có khắc phục đươc vấn đề bạn tìm hiểu ko?, nếu ko hãy comment góp ý thêm về CuSO4 + NaOH → Cu(OH)2 + Na2SO4
bên dưới đểHọc viện Anh ngữ toàn diện NYSE có thể thay đổi & cải thiện nội dung tốt hơn cho các bạn nhé! Cám ơn bạn đã ghé thăm Website: nyse.edu.vn của Học viện Anh ngữ toàn diện NYSE
Nhớ để nguồn bài viết này: CuSO4 + NaOH → Cu(OH)2 + Na2SO4
của website nyse.edu.vn
Chuyên mục: Giáo dục
[expander_maker more=”Xem thêm chi tiết về CuSO4 + NaOH → Cu(OH)2 + Na2SO4
” less=”Read less”]
Tóp 10 CuSO4 + NaOH → Cu(OH)2 + Na2SO4
#CuSO4 #NaOH #CuOH2 #Na2SO4
Video CuSO4 + NaOH → Cu(OH)2 + Na2SO4
Hình Ảnh CuSO4 + NaOH → Cu(OH)2 + Na2SO4
#CuSO4 #NaOH #CuOH2 #Na2SO4
Tin tức CuSO4 + NaOH → Cu(OH)2 + Na2SO4
#CuSO4 #NaOH #CuOH2 #Na2SO4
Review CuSO4 + NaOH → Cu(OH)2 + Na2SO4
#CuSO4 #NaOH #CuOH2 #Na2SO4
Tham khảo CuSO4 + NaOH → Cu(OH)2 + Na2SO4
#CuSO4 #NaOH #CuOH2 #Na2SO4
Mới nhất CuSO4 + NaOH → Cu(OH)2 + Na2SO4
#CuSO4 #NaOH #CuOH2 #Na2SO4
Hướng dẫn CuSO4 + NaOH → Cu(OH)2 + Na2SO4
#CuSO4 #NaOH #CuOH2 #Na2SO4
Tổng Hợp CuSO4 + NaOH → Cu(OH)2 + Na2SO4
Wiki về CuSO4 + NaOH → Cu(OH)2 + Na2SO4
[/expander_maker]