FeO + HNO3 → Fe(NO3)3 + NO2 + H2O do trường THPT Chuyên Lê Hồng Phong biên soạn xin gửi tới quý độc giả cách phản ứng của FeO với HNO3 đặc nóng bằng phương pháp electron. Hi vọng sẽ giúp các bạn học sinh có thêm tài liệu học tập. Hãy kiểm tra.
1. Phương trình giữa FeO và HNO3 đặc nóng
FeO + 4HNO3 → Fe(NO3)3 + NO2 + 2H2O
2. Hướng dẫn điều khiển phản ứng FeO + HNO3 → Fe(NO3)3 + NO2 + H2O
Fe+2O + HN+5O3 → Fe+3(NO3)3 + N+4O2 + H2O
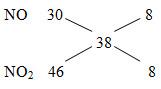
sử dụng điện tử
Bạn thấy: FeO + HNO3 → Fe(NO3)3 + NO2 + H2O
|
1 x là 1 x là |
Fe+2 → Fe3++ 1e N+5 + 1e → N+4 |
Vì vậy, chúng ta có phương trình:
FeO + 4HNO3 → Fe(NO3)3 + NO2 + 2H2O
3. Phản ứng FeO HNO3 đặc nóng
HNO3 đặc nóng
4. Tính chất của sắt(II) oxit FeO
Hàng cơ thể
FeO là chất rắn màu đen, không có trong tự nhiên.
Không tan trong nước.
nhà thuốc
Sản phẩm sắt(II) vừa có tính khử vừa có tính oxi hóa nhưng tính khử là trực tiếp vì trong các phản ứng hóa học ion Fe2+ dễ dàng nhường 1e cho ion Fe3+.
Fe2+++ 1e → Fe3+
Tính chất của sản phẩm sắt(II) là tính khử.
Các hợp chất sắt(II) nói chung không bền và dễ bị oxi hoá thành các hợp chất sắt(III).
FeO là một oxit quan trọng, hơn nữa do nó có số oxi hóa +2 – số oxi hóa trung tính => FeO vừa có tính khử vừa có trạng thái oxi hóa.
FeO là một oxit quan trọng:
+Phản ứng với dung dịch axit: HCl; H2SO4 loãng…
FeO + 2HCl → FeCl2 + H2
Khử FeO + H2SO4 → FeSO4 + H2O
FeO có tính oxi hóa khi tác dụng với chất khử mạnh: H2, CO, Al → Fe:FeO + H2 Fe + H2O
FeO + CO Fe + CO2
3FeO + 2Al Al2O3 + 3Fe
FeO là chất khử khi phản ứng với chất oxi hóa mạnh: HNO3; Độ ổn định của H2SO4; O2…4FeO + O22Fe2O3 là
Khử 3FeO + 10HNO3 → 3Fe(NO3)3 + NO + 5H2O
FeO đặc, nóng + 4HNO3 → Fe(NO3)3 + NO2 + 2H2O
2FeO + 4H2SO4 đặc, nóng → Fe2(SO4)3 + SO2 + 4H2O
5. Hoạt động tương tự
Câu 1. Dung dịch FeSO4 không đổi màu theo cách nào sau đây?
Dung dịch A. KMnO4 trong H2SO4
B. Dung dịch K2Cr2O7 trong H2SO4
C.Br2 . giải pháp
D. CuCl2 . giải pháp
CÂU TRẢ LỜI ĐƠN GIẢN
A. Màu tím hồng nhạt dần sang màu vàng
10FeSO4 + 2KMnO4 + 8H2SO4 → 5Fe2(SO4)3 + K2SO4 + 2MnSO4+ 8H2O
B. Dung dịch chuyển từ màu trắng xanh sang màu da cam.
6FeSO4 + K2Cr2O7 + 7H2SO4 → 3Fe2(SO4)3 + Cr2(SO4)3 + K2SO4 + 7H2O
C. Dung dịch nước brom đổi màu
2FeSO4 + Br2 + 3H2O → Fe2O3 + 2HBr + 2H2SO4
D. FeSO4 Bất biến CuCl2
Câu 2: Cho 5,4 gam hỗn hợp 2 kim loại Fe và Zn phản ứng hết với 90 ml dung dịch HCl 2M. Khối lượng muối thu được là
A. 11,79 gam
B. 11,5 gam
C. 15,71 gam
D. 17,19 gam
CÂU TRẢ LỜI ĐƠN GIẢN
nHCl = 0,09. 2 = 0,18 (mol)
Zn + 2HCl → ZnCl2 + H2
Fe + 2HCl → FeCl2 + H2
Từ (1) và (2) nH2 = 1/2nHCl = 0,09 (mol)
Theo SDLC:
hỗn hợp + maxit = mmuối + mhiđro
=> mmuối = 5,4 + 0,18.36,5 – 0,09.2 = 11,79 gam
Câu 3. Dung dịch khử chứa 0,01 mol Fe(NO3)3 và 0,15 mol HCl có thể hòa tan một lượng lớn Fe là:
A. 0,28 gam
B. 1,68 gam
C. 4,20 gam
D. 3,64 gam
CÂU TRẢ LỜI ĐƠN GIẢN
Theo đề bài lượng Fe phản ứng nhiều nên sau phản ứng chỉ tạo muối sắt (II).
3Fe + 8H+ + 2NO3– → 3Fe2+ + 2NO + 4H2O
0,045 0,15 0,03 mol
Fe + 2Fe3+ → 3Fe2+
0,005 0,01 mol
Fe + 2H+ → Fe2+ + H2
0,015 (0,15 – 4,0,03)
nFe = 0,045 + 0,005 + 0,015 = 0,065 mol
mFe = 3,64 gam
Câu 4. Hợp chất kiềm nào sau đây có thể phản ứng với HCl khi đun nóng?
A. FeBr2
B. FeSO4
C. Fe(NO3)2
D. Fe(NO3)3
CÂU TRẢ LỜI CŨ
Câu 5. Hòa tan hỗn hợp ba kim loại gồm Zn, Fe, Cu bằng dung dịch HNO3 khử. Sau phản ứng thu được chất rắn không tan là Cu. Câu trả lời sau đó là
A. Zn(NO3)2 và Fe(NO3)3.
B. Zn(NO3)2; Fe(NO3)2 và Cu(NO3)2.
C. Zn(NO3)2 và Fe(NO3)2.
D. Zn(NO3)2; Fe(NO3)3 và Cu(NO3)2.
CÂU TRẢ LỜI ĐƠN GIẢN
Sau đó còn lại Cu chứng tỏ HNO3 đã phản ứng hết.
3Zn + 8HNO3 → 3Zn(NO3)2 + 2NO + 4H2O
Fe + 4HNO3 → Fe(NO3)3 + NO + 2H2O
3Cu + 8HNO3 → 3Cu(NO3)2 + 2NO + 4H2O
Cu + 2Fe(NO3)3 → Cu(NO3)2 + 2Fe(NO3)2
=> Dung dịch sau phản ứng chứa: Zn(NO3)2; Fe(NO3)2; Cho (NO3)2.
Câu 6. Có thể dùng chất nào sau đây để điều chế FeO?
A. Dùng CO để khử Fe2O3 ở 500°C.
B. Nhiệt phân Fe(OH)2 trong không khí.
C. Nhiệt phân Fe(NO3)2
D. Đốt cháy FeS trong không khí.
Đáp án A
phương trình phản ứng
Fe2O3 + CO → 2FeO + CO2 (500oC)
Câu 7. Để hòa tan hoàn toàn 2,8 gam hỗn hợp gồm FeO, Fe2O3 và Fe3O4 cần V ml dung dịch HCl 1M thu được dung dịch X. Cho từ từ dung dịch NaOH vào dung dịch X thu được khí. Y. Đốt cháy Y trong không khí đến khối lượng không đổi. sinh ra 3 gam chất rắn. Tính V?
A.87,5ml
B. 125ml
C.62,5ml
D. 175ml
Đáp án A
Quy đổi thành 2,8 gam (Fe:x mol và O:y mol)
Biểu đồ chính thức:
2Fe → Fe2O3
Chúng ta có:
nFe = 2nFe2O3 = 2,3/160 = 0,0375 mol
=> noO (noside) = ( 2,8 – 0,0375,56 )/16 = 0,04375 mol
=> nHCl pư = 2nO(oxit) = 0,0875 mol
=> V = 87,5ml
Câu 8. Phản ứng nào sau đây không tạo ra muối sắt(III)?
A. Fe2O3 phản ứng với HCl đặc
B. Fe(OH)3 phản ứng với H2SO4 . giải pháp
C. Cho Fe phản ứng hết với dung dịch HNO3 đặc nguội
D. FeO tham gia khử (cộng) dd HNO3.
CÂU TRẢ LỜI CŨ
Fe2O3 + 6HCl → 2FeCl3 + 3H2O
2Fe(OH)3 + 3H2SO4 → Fe2(SO4)3 + 6H2O
Fe bị thụ động hóa bởi HNO3 đặc nguội.
FeO + HNO3 → Fe(NO3)3 + NO + H2O
Câu 9. Thổi hỗn hợp CO và H2 qua x gam hỗn hợp CuO và Fe3O4 có tỉ lệ mol tương ứng là 1:2, sau phản ứng thu được y gam chất rắn X. Hòa tan hoàn toàn b gam X bằng dung dịch. Dung dịch HNO3 loãng dư thu được dung dịch Y (không chứa ion Fe2+). Cô cạn dung dịch Y thu được 41 gam muối khan. Giá trị của một
Một .13.6
B. 10,6.
C. 12,8.
D. 9,8.
Đáp án A
nCu = mol;
nFe3O4 = 2a mol;
→ nCu(NO3)2 = a; nFe(NO3)3 = 6a mol
mmuối = mCu(NO3)2 + mFe(NO3)3
→ 188a + 242,6a = 41 → a = 0,025 mol
→ x = 0,025.80 + 0,025.2.232 = 13,6 gam.
———————————
Mời xem các bài viết liên quan
Gửi đến các bạn phương trình FeO + HNO3 → Fe(NO3)3 + NO2 + H2O do trường THPT Chuyên Lê Hồng Phong biên soạn và hoàn thiện gửi đến các bạn. Hi vọng tài liệu giúp các bạn biết cách viết đúng và đủ phương trình phản ứng, hiện tượng xảy ra sau phản ứng khi cho Fe phản ứng với dd HNO3 dư tính khử.
Các em cũng có thể tham khảo thêm các bài viết tương tự khác giúp ích cho việc học tập như: Giải bài tập Hóa 12 , Giải bài tập Toán lớp 12 , Giải bài tập Vật Lý 12 ,….
Ngoài ra, trường THPT Chuyên Lê Hồng Phong đã lập nhóm chia sẻ tài liệu ôn thi THPT Quốc gia miễn phí trên Facebook: Tài liệu học tập lớp 12 Mời các em tham gia nhóm để nhận tài liệu và đề.
Tác giả: Học viện Anh ngữ toàn diện NYSE
Thể loại: Giáo dục
Bài chia sẻ: https://c3lehongphonghp.edu.vn https://c3lehongphonghp.edu.vn/feo-hno3-feno33-no2-h2o/
Bạn thấy bài viết
FeO + HNO3 → Fe(NO3)3 + NO2 + H2O
có khắc phục đươc vấn đề bạn tìm hiểu ko?, nếu ko hãy comment góp ý thêm về
FeO + HNO3 → Fe(NO3)3 + NO2 + H2O
bên dưới đểHọc viện Anh ngữ toàn diện NYSE có thể thay đổi & cải thiện nội dung tốt hơn cho các bạn nhé! Cám ơn bạn đã ghé thăm Website: nyse.edu.vn của Học viện Anh ngữ toàn diện NYSE
Nhớ để nguồn bài viết này:
FeO + HNO3 → Fe(NO3)3 + NO2 + H2O
của website nyse.edu.vn
Chuyên mục: Giáo dục
[expander_maker more=”Xem thêm chi tiết về
FeO + HNO3 → Fe(NO3)3 + NO2 + H2O
” less=”Read less”]
Tóp 10
FeO + HNO3 → Fe(NO3)3 + NO2 + H2O
#FeO #HNO3 #FeNO33 #NO2 #H2O
Video
FeO + HNO3 → Fe(NO3)3 + NO2 + H2O
Hình Ảnh
FeO + HNO3 → Fe(NO3)3 + NO2 + H2O
#FeO #HNO3 #FeNO33 #NO2 #H2O
Tin tức
FeO + HNO3 → Fe(NO3)3 + NO2 + H2O
#FeO #HNO3 #FeNO33 #NO2 #H2O
Review
FeO + HNO3 → Fe(NO3)3 + NO2 + H2O
#FeO #HNO3 #FeNO33 #NO2 #H2O
Tham khảo
FeO + HNO3 → Fe(NO3)3 + NO2 + H2O
#FeO #HNO3 #FeNO33 #NO2 #H2O
Mới nhất
FeO + HNO3 → Fe(NO3)3 + NO2 + H2O
#FeO #HNO3 #FeNO33 #NO2 #H2O
Hướng dẫn
FeO + HNO3 → Fe(NO3)3 + NO2 + H2O
#FeO #HNO3 #FeNO33 #NO2 #H2O
Tổng Hợp
FeO + HNO3 → Fe(NO3)3 + NO2 + H2O
Wiki về
FeO + HNO3 → Fe(NO3)3 + NO2 + H2O
[/expander_maker]