Kim loại phản ứng với nước: lý thuyết, ví dụ và bài tập
Thay vào đó, các kim loại khác phản ứng với nước di chuyển từ Mg vào bảng tuần hoàn. Ví dụ: Al, Zn, vẫn hoạt động và tạo ra khí H2. Tuy nhiên, trong chương trình hóa học lớp 9 chúng ta không học các kim loại nặng như Al, Zn mà học 5 kim loại trong đó có kim loại kiềm và kiềm thổ. Hãy cùng tìm hiểu sâu hơn trong bài viết này!

Tin tốt
Bạn xem: Kim loại phản ứng với nước: lý thuyết, ví dụ và bài tập
- Phương trình hóa học của kim loại phản ứng với nước
-
Đội thể thao công việc kim loại và nước
- Dạng 1: Xác định khối lượng bazơ và hiđro sau phản ứng
- Dạng 2: Trùng hợp một bazơ với một lượng axit. Xác định khối lượng muối tạo thành sau phản ứng.
- Dạng 3: Tính khối lượng bazơ mới hoặc muối mới tạo thành sau phản ứng dung dịch sau phản ứng
- Tập thể dục với nước
Phương trình hóa học của kim loại phản ứng với nước
Như đã đề cập, các kim loại kiềm và kiềm thổ phản ứng với nước. Trong chương trình này, chúng tôi đang nghiên cứu các kim loại phổ biến như Ca (Canxi), Ba (Bari), Na (Natri). Phương trình kết quả tạo thành một bazơ và khí H2 được giải phóng.
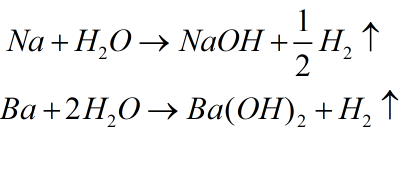
Công thức chung của kim loại phản ứng với nước theo hóa trị:
Hóa trị I:
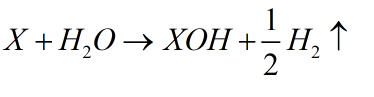
Hóa trị II:
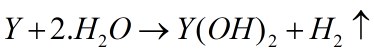
Đội thể thao công việc kim loại và nước
Sau khi tìm hiểu về tính chất hóa học của kim loại khi phản ứng với nước, dưới đây là một số dạng bài tập các em học sinh thường gặp khi học tập và làm bài thi.
Dạng 1: Xác định khối lượng bazơ và hiđro sau phản ứng
Đối với những gì kim loại là nước. Xác định lượng bazơ tạo thành do khí hiđro bay lên. Trong bài toán này, chúng ta sử dụng các phương pháp sau để tìm nhanh số chấm của một đối tượng vì đây là phép toán đơn giản:
- thấp hơn noH = 2
- Định lý về hóa trị: (Hóa trị của kim loại) x (số mol kim loại) = 2 x (số mol khí H2 thoát ra)
Dạng 2: Trùng hợp một bazơ với một lượng axit. Xác định khối lượng muối tạo thành sau phản ứng.
Với cách giải này, học sinh cần linh hoạt trong việc vận dụng các quy tắc vào hóa học. Đặc biệt là định luật bảo toàn điện tích
- nH+ = nOH- = 2nH2
- Ví dụ, NaOH là n(NaOH) = 2nH2.
- Khối lượng muối: m = Mn (với n là số hạt muối)
Dạng 3: Tính khối lượng bazơ mới hoặc muối mới tạo thành sau phản ứng dung dịch sau phản ứng
Khác với toán 2 vì cơ sở sinh ra thường là sóng. Do đó, dữ kiện của bài toán sẽ hơi khác một chút nhưng đáp án và cách giải của bài toán sẽ giống nhau.
Tập thể dục với nước
Câu hỏi 1:
Tại sao khi cho vôi sống vào nước ta thấy có khói, nước vôi trong có vẻ như đang sôi và nhiệt độ của hố vôi rất cao, có thể gây nguy hiểm cho người và động vật? Vậy có nên để cách xa hố đã bôi trơn hoặc sau khi quét vôi ít nhất 2 ngày? (sách)
Hồi đáp:
Như đã nói Canxi (Ca) phản ứng rất mạnh với nước ở điều kiện thường. Phương trình hóa học:
Ca + 2H2O —> Ca(OH)2 +H2O
Ở trên tỏa nhiều nhiệt làm dung dịch sôi. Chất hóa hơi là những hạt Ca(OH)2 siêu nhỏ xuất hiện dưới dạng sương trắng. Đây là bài tập tìm hiểu về tác dụng của thuốc.
Phần 2:
Khi cho 7,9 gam hỗn hợp K và Ca vào nước thu được dung dịch X và 3,36 lít khí H2. Tính khối lượng mỗi kim loại trong hỗn hợp?
Hồi đáp:
Gọi số hạt K, Ca trong hỗn hợp lần lượt là a, b ta có hệ phương trình sau:
39a + 40b = 7,9 (1)
1.a + 2.b = 2. 3,36/22,4 (2).
Giải phương trình bậc cao ta được = b = 0,1. Suy ra: mK = 3,9; mCA = 40
Từ ví dụ trên, chúng ta có thể thấy rằng việc biết phương trình hoạt động như thế nào sẽ giúp chúng ta thiết lập mối quan hệ và giải pháp cho vấn đề.
Câu 3: Hòa tan hoàn toàn 2,3 gam Na trong 120 gam H2O, sau phản ứng thu được dung dịch X và V lít khí H2 (dktc).
a) Tính V?
b) Tính phần trăm câu trả lời bạn nhận được?
Hồi đáp:
a) Áp dụng định luật bảo toàn ta tính nhanh được biểu thức sau:
1.nNa = 2nH2 đến nH2 = 0,05; VH2 = 1,12 (lít)
b) Để tính thể tích dung dịch ta cần biết các chất có trong dung dịch và thể tích của nó để có kết quả chính xác nhất.
Công thức được xác định như sau: C%(NaoH) = [mNaOH/mdd].100%
Ở đây dùng định luật bảo toàn khối lượng sẽ cho kết quả rất nhanh: nNaOH = nNa = 0,1 à mNaOH = 4 gam
Từ đó dễ dàng tính được phần trăm của đáp án: 3,273%
Câu 4: 8,5g hỗn hợp gồm Na và k phản ứng hết với nước thu được 3,36l khí hiđro (dktc) và dung dịch X. Cho X phản ứng vừa đủ với dung dịch Fe2(SO4)3 thu được m(g)) kết tủa . Giá trị của m là:
Trả lời: Đây là yếu tố rủi ro được tổng hợp và thể hiện bằng 3 thuật ngữ toán học.
Áp dụng định luật bảo toàn khối lượng ta có:
nOH- = 2nH2 = 2. = 0,3 mol.
Dễ dàng nhận thấy kết tủa trong bài toán này là: Fe(OH)3 (Vì Fe trong bài toán tồn tại ở hóa trị III)
Vậy: nFe(OH)3 = 0,3/3 = 0,1
Khối lượng cacbon sinh ra là: mFe(OH)3 = 107 x 0,1 = 10,7 (g)
Như vậy là chúng ta vừa cùng nhau trình bày toàn bộ các bài toán liên quan đến phản ứng của kim loại với nước. Từ phương trình hóa học, tính chất của phương trình và các dạng bài tập khác là rất quan trọng. Nếu trong quá trình học các bạn còn vướng mắc về kiến thức, hãy để lại bình luận bên dưới bài viết này để chúng tôi khắc phục trong thời gian sớm nhất. Chúc may mắn với các nghiên cứu của bạn
Tác giả: Học viện Anh ngữ toàn diện NYSE
Thể loại: Giáo dục
Bài chia sẻ: https://c3lehongphonghp.edu.vn https://c3lehongphonghp.edu.vn/kim-loai-tac-dung-voi-nuoc-ly-thuyet-vi-du-va-bai-tap/
Bạn thấy bài viết
Kim loại tác dụng với nước: lý thuyết, ví dụ và bài tập
có khắc phục đươc vấn đề bạn tìm hiểu ko?, nếu ko hãy comment góp ý thêm về
Kim loại tác dụng với nước: lý thuyết, ví dụ và bài tập
bên dưới đểHọc viện Anh ngữ toàn diện NYSE có thể thay đổi & cải thiện nội dung tốt hơn cho các bạn nhé! Cám ơn bạn đã ghé thăm Website: nyse.edu.vn của Học viện Anh ngữ toàn diện NYSE
Nhớ để nguồn bài viết này:
Kim loại tác dụng với nước: lý thuyết, ví dụ và bài tập
của website nyse.edu.vn
Chuyên mục: Giáo dục
[expander_maker more=”Xem thêm chi tiết về
Kim loại tác dụng với nước: lý thuyết, ví dụ và bài tập
” less=”Read less”]
Tóp 10
Kim loại tác dụng với nước: lý thuyết, ví dụ và bài tập
#Kim #loại #tác #dụng #với #nước #lý #thuyết #ví #dụ #và #bài #tập
Video
Kim loại tác dụng với nước: lý thuyết, ví dụ và bài tập
Hình Ảnh
Kim loại tác dụng với nước: lý thuyết, ví dụ và bài tập
#Kim #loại #tác #dụng #với #nước #lý #thuyết #ví #dụ #và #bài #tập
Tin tức
Kim loại tác dụng với nước: lý thuyết, ví dụ và bài tập
#Kim #loại #tác #dụng #với #nước #lý #thuyết #ví #dụ #và #bài #tập
Review
Kim loại tác dụng với nước: lý thuyết, ví dụ và bài tập
#Kim #loại #tác #dụng #với #nước #lý #thuyết #ví #dụ #và #bài #tập
Tham khảo
Kim loại tác dụng với nước: lý thuyết, ví dụ và bài tập
#Kim #loại #tác #dụng #với #nước #lý #thuyết #ví #dụ #và #bài #tập
Mới nhất
Kim loại tác dụng với nước: lý thuyết, ví dụ và bài tập
#Kim #loại #tác #dụng #với #nước #lý #thuyết #ví #dụ #và #bài #tập
Hướng dẫn
Kim loại tác dụng với nước: lý thuyết, ví dụ và bài tập
#Kim #loại #tác #dụng #với #nước #lý #thuyết #ví #dụ #và #bài #tập
Tổng Hợp
Kim loại tác dụng với nước: lý thuyết, ví dụ và bài tập
Wiki về
Kim loại tác dụng với nước: lý thuyết, ví dụ và bài tập
[/expander_maker]