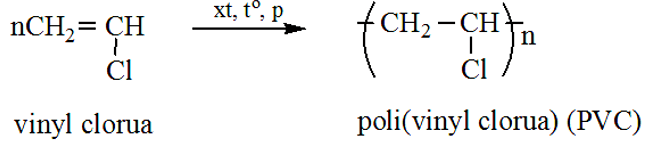SO2 + H2S → S + H2O do trường Học viện Anh ngữ toàn diện NYSE biên soạn nhằm hướng dẫn học sinh viết phương trình từ SO2 đến S, đây là cách viết phương trình chứng tỏ lưu huỳnh đioxit có thể oxi hóa SO2 khi phản ứng với H2S. Xin vui lòng xem thêm chi tiết dưới đây.
1. Phản ứng H2S tạo ra S
SO2 + 2H2S → 3S↓ + 2H2O
SO2 là chất oxi hóa (bị khử) và H2S là chất khử (bị oxi hóa).
2. SO2 . sự phản ứng lại
Nhiệt độ bình thường
Bạn thấy: SO2 + H2S → S + H2O
3. Phản ứng giữa SO2 và H2S
Xuất hiện kết tủa lưu huỳnh (S) màu vàng
4. Thao tác tương tự
Câu 1. Cho phản ứng: SO2 + 2H2S → 3S + 2H2O. Câu nào mô tả đúng nhất tình huống?
A. SO2 bị oxi hóa, H2S bị khử.
B. SO2 bị khử và H2S bị oxi hóa.
C. SO2 khử được H2S và không có sản phẩm bị oxi hóa.
D. SO2 bị khử, lưu huỳnh bị oxi hóa.
Câu trả lời là không
Câu 2. Để nhận biết SO2, SO3 người ta dùng thuốc thử:
A. Nước khử trùng bằng clo
B. Bỏ nước cốt chanh
C. dung dịch brom
D. Tất cả đều không ổn
CÂU TRẢ LỜI CŨ
Câu 3. Để oxi hóa cùng một số phân tử H2S trong điều kiện (không cân bằng) nào sau đây thì lượng chất oxi hóa phải dùng nhiều hơn?
A. H2S + O2 → S +H2O
B. H2S + K2Cr2O7 + H2SO4 → S + Cr2(SO4)3 + K2SO4 + H2O
C. H2S + Cl2 + H2O → H2SO4 + HCl
D. H2S + SO2 → S + H2O
CÂU TRẢ LỜI CŨ
Câu 4. Hiện tượng nào sau đây không phải là phản ứng hóa học?
A. 3O2 + 2H2S → 2H2O + 2SO2
B. FeCl2 + H2S → FeS + 2HCl
C. SO2 + 2H2S → 3S + 2H2O
D. SO3 + 2NaOH → Na2SO4 + H2O
Câu trả lời là không
Câu 5. Cho V (lít) SO2 (dktc) tan hoàn toàn trong 100ml dung dịch NaOH 2M thu được hỗn hợp 2 muối có khối lượng 16,7g.
A. 3,36 lít
B. 1,87 lít
C. 4,48 lít
D. 1,12 lít
Đáp án A
phương trình hóa học
NaOH + SO2 → NaHSO3
NaOH + 2SO2 → Na2SO3 + H2O
Gọi x, y lần lượt là số giọt 2 muối NaHSO3, Na2SO3.,
Cứu nguyên tố Na có nNaHSO3 + 2.nNa2SO3 = nNaOH => x + 2y = 0,2
mNaHSO3 + mNa2SO3 = 16,7 <=> 104x + 126y = 16,7
=> x = 0,1; y = 0,05
Nồng độ nguyên tố S là: nSO2 = nNaHSO3 + nNa2SO3 = x + y = 0,1 + 0,05 = 0,15
=> V = 0,15.22,4 = 3,36 lít
Câu 6. Thí nghiệm: Khi cho khí H2S đi qua dung dịch CuSO4 thấy xuất hiện chất lỏng màu xám, chứng tỏ:
A. Có khí trắng bay ra
B. Kết tủa CuS, không tan trong axit mạnh
C. Axit sunfuric mạnh hơn axit sunfuric
D. Axit sunfuric mạnh hơn axit sunfuric
Đáp án B: Khi cho khí H2S đi qua dung dịch CuSO4 thấy xuất hiện kết tủa xám đen chứng tỏ có tạo thành kết tủa CuS, không tan trong axit mạnh.
Câu 7. Để điều chế khí H2S người ta dùng hóa chất theo các bước sau
A. Mg không phản ứng mạnh với H2SO4
B. FeS phản ứng với HCl loãng
C. FeS phản ứng với dung dịch H2SO4 đặc
DS phản ứng với H2
Câu trả lời là không
Câu 8. Trộn 400 ml dung dịch NaOH 1M với 300ml dung dịch H2SO4 1M. Những khoáng chất được tìm thấy sau khi hoàn thành?
A. 19,1 gam
B. 9,55 gam
C. 38,2 gam
D. 6,7 gam
CÂU TRẢ LỜI CŨ
Ta có: nNaOH = 0,4 .1 = 0,4 (mol); nH2SO4 = 0,3 mol
phương trình phản ứng
NaOH + H2SO4 → NaHSO4 + H2O
(mol) 0,3 0,3 → 0,3
NaOH + NaHSO4 → Na2SO4 + H2O
(mol) 0,1 → 0,1
⇒ lượng nNaHSO4 = 0,3 – 0,1 = 0,2 (mol)
⇒ mmuối = mNaHSO4 + mNaSO4 = 120.0,2 + 142.0,1 = 38,2 gam
Câu 9. Nếu cho quá nhiều H2SO4 vào thì phát biểu nào sau đây đúng:
A. Cho từ từ H2SO4 đặc vào nước và lắc đều
B. Cho từ từ nước vào dung dịch H2SO4 và lắc đều
C. Đổ đồng thời nước và axit vào cốc và lắc đều
D. Cho nhanh H2SO4 vào nước và khuấy đều
Đáp án A
Câu 10. Cho 1,84 gam hỗn hợp gồm Al và Zn đem hoà tan bằng một lượng vừa đủ dung dịch H2SO4 10% thu được 1,12 lít khí H2 (ở đktc). Hầu hết các câu trả lời được tìm thấy sau câu trả lời là:
A. 101,48 gam
B. 101,68 gam
C. 50,74 gam
D. 88,20 gam
CÂU TRẢ LỜI CŨ
Ta có: nH2SO4 = nH2 = 1,12/22,4 = 0,05 mol
→ mH2SO4 = 0,05 .98 = 4,9 gam → mdd H2SO4 = (4,9.100)/10 = 49 gam
Thực hiện theo quy tắc chung của ngón tay cái:
hỗn hợp KL + mdd H2SO4 = mdd sau phản ứng + mH2
→ mdd sau phản ứng = m hỗn hợp KL + mdd H2SO4–mH2 = 1,84 + 49 – 0,05. 2 = 50,74 gam
…………………….
Mời xem các bài viết liên quan khác
Trên đây Trường THPT Chuyên Lê Hồng Phong mang đến cho các bạn những bài soạn SO2 + H2S → S + H2O hữu ích nhất. Để có kết quả cao hơn trong học tập, trường Học viện Anh ngữ toàn diện NYSE xin giới thiệu đến các em học sinh Chuyên đề Toán 9, Chuyên đề Vật lý 9, Lý thuyết Sinh học 9, Giải bài tập Hóa học 9, Tài liệu học tập năng khiếu lớp 9 trường THPT Chuyên Lê Hồng Phong đã phát triển và cài đặt.
Ngoài ra, trường THPT Chuyên Lê Hồng Phong đã thành lập nhóm chia sẻ tài liệu học tập THPT miễn phí trên Facebook: luyện thi vào lớp 9 lên 10. Mời các em tham gia nhóm để nhận được những tài liệu mới nhất.
Tác giả: Học viện Anh ngữ toàn diện NYSE
Thể loại: Giáo dục
Bài chia sẻ: https://c3lehongphonghp.edu.vn https://c3lehongphonghp.edu.vn/so2-h2s-s-h2o/
Bạn thấy bài viết SO2 + H2S → S + H2O
có khắc phục đươc vấn đề bạn tìm hiểu ko?, nếu ko hãy comment góp ý thêm về SO2 + H2S → S + H2O
bên dưới đểHọc viện Anh ngữ toàn diện NYSE có thể thay đổi & cải thiện nội dung tốt hơn cho các bạn nhé! Cám ơn bạn đã ghé thăm Website: nyse.edu.vn của Học viện Anh ngữ toàn diện NYSE
Nhớ để nguồn bài viết này: SO2 + H2S → S + H2O
của website nyse.edu.vn
Chuyên mục: Giáo dục
[expander_maker more=”Xem thêm chi tiết về SO2 + H2S → S + H2O
” less=”Read less”]
Tóp 10 SO2 + H2S → S + H2O
#SO2 #H2S #H2O
Video SO2 + H2S → S + H2O
Hình Ảnh SO2 + H2S → S + H2O
#SO2 #H2S #H2O
Tin tức SO2 + H2S → S + H2O
#SO2 #H2S #H2O
Review SO2 + H2S → S + H2O
#SO2 #H2S #H2O
Tham khảo SO2 + H2S → S + H2O
#SO2 #H2S #H2O
Mới nhất SO2 + H2S → S + H2O
#SO2 #H2S #H2O
Hướng dẫn SO2 + H2S → S + H2O
#SO2 #H2S #H2O
Tổng Hợp SO2 + H2S → S + H2O
Wiki về SO2 + H2S → S + H2O
[/expander_maker]